Study 1
巨核球造血微小環境の解明
生体の止血を司り、個体の発生から恒常性維持まで幅広い機能を持つ血小板
その血小板は骨髄で造血幹細胞から分化した「巨核球」から生み出されます
近年、巨核球の分化(巨核球造血)は近接する他の細胞やタンパク質といった「骨髄環境」に多大な影響を受けることがわかってきました
私達はこの巨核球造血を制御する骨髄環境を明らかにし、疾患の解明や再生医療への発展に挑みます
Contents
Introduction
骨髄微小環境とPDPN陽性細網細胞の発見

Project 1
PDPN陽性細網細胞の分化系譜の解明

Project 2
骨髄造血環境の再現による造血疾患の病態解明および
再生医療へ貢献

Introduction
骨髄造血微小環境とは
- 骨髄は血球細胞の産生に特化した組織です。骨にパッキングされる骨髄は軟組織ですが、細胞外マトリックス、脈管系、そして間質細胞によって複雑な3次元ネットワークが構成されています。
- 特に『間質細胞』は骨髄内に局所的な微小環境(ニッチ)を構成し、造血幹細胞を含む各種血球前駆細胞の分化・成熟を厳密にコントロールしていることがわかりはじめています。
- ヒトでは1日で新規に産生される血小板数は 1011個と見込まれています。個体維持に要する血小板数を確保するためには巨核球の細胞自律的な分化・成熟機能だけではなく、微小環境による高度に制御された巨核球造血制御システムが必要です。
巨核球造血を制御する新しい骨髄間質細胞 「PDPN陽性細網細胞」の発見
- 「Podoplanin (PDPN)」は血小板・巨核球膜タンパク「C-type lectin-like receptor 2 (CLEC-2)」の生体内リガンドです。CLEC-2ノックアウトマウスは血小板減少を呈するものの、その病態メカニズムは不明でした。
- 我々はCLEC-2の血小板・巨核球造血調節機構を解析する過程でPDPNを発現する新規傍細動脈細網細胞 (PDPN陽性細網細胞)を発見しました (Tamura S et al. Blood. 2016)。
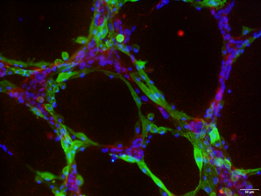
- PDPN陽性細網細胞はPDPN/CLEC-2結合を介して巨核球と相互作用し、細動脈近傍に巨核球造血微小環境を構成することを明らかにしました (右図)。

- 造血幹細胞を支持する骨髄間質細胞はNestin陽性間葉系細胞やCXCL12陽性細網細胞などが同定されており、機能や細胞特性の解明が進んでいます。
- 一方、巨核球系細胞を制御する骨髄微小環境の知見は極めて乏しく、現在、明確に存在が示されている巨核球造血支持細胞はPDPN陽性細網細胞のみです。
- 本研究はPDPN陽性細網細胞の理解によって骨髄巨核球造血メカニズムの解明を目指す、世界に先駆けた独自性と創造性の高い研究であると考えています。
Project 1 PDPN陽性細網細胞の分化系譜の解明
本プロジェクトの目的
- PDPN陽性細網細胞を生み出す体性幹細胞および分化系統を明らかにし、骨髄巨核球造血微小環境の成り立ちを解明する
本プロジェクトの核心をなす学術的な問い
- PDPN陽性細網細胞の細胞起源や分化系譜はまったく理解されておらず、造血を制御する間質細胞の由来はどのような体性幹細胞であるかがわかっていません (右図)。
本プロジェクトの戦略
- 本研究プロジェクトはマウス骨髄から分離した間質細胞を対象に、遺伝子発現プロファイリング、分化能、細胞外マトリックス産生能、脈管ネットワーク形性能、巨核球造血制御能などの検討によって、PDPN陽性細網細胞の体性幹細胞を同定し、複雑な骨髄巨核球造血環境との関係性を明らかにしていきます。

本プロジェクトの発展性 - 個体発生に伴う骨髄環境構築の時空間的理解 -
- 個体発生に伴い、間質細胞たちが「いつ」そして「どのように」骨髄空間に分布していくかは全くわかっていません。その問題点は、骨髄間質細胞の細胞起源や細胞特性が不明であるため、各種間質細胞のin vivo系譜追跡イメージングができないことにあります。
- PDPN陽性細網細胞の起源が明らかになれば、巨核球造血微小環境の時空間的成り立ちを解析することが可能になります。
- 巨核球造血環境の時空間的理解は、巨核球の異常制御が発症の一因と考えられている造血器疾患(骨髄線維症など)の病態解明につながることが予想され、 新たな診断方法や治療方針開発への発展が期待されます (右図)。

Project 2 骨髄造血環境の再現による造血疾患の病態解明や再生医療へ貢献
■ 骨髄微小環境を応用した高効率血小板培養系の構築
- 2010年に誘導型多能性幹細胞 (induced pulripotent stem cell: iPS細胞)を用いた血小板のin vitro産生技術が開発されて以来、献血に頼らない血小板製剤への応用が期待されています。
- iPS細胞由来血小板製剤の開発は、各種ヒト白血球抗原 (HLA) およびヒト血小板抗原 (HPA) に対応した適合血小板製剤の調製を可能とし、輸血医療の安全性向上が期待されています。
- iPS細胞由来血小板製剤は臨床応用の目前まできていますが、実臨床の需要を満たすレベルのin vitro血小板産生効率を得るためには、まだまだ巨核球培養システムの改良が必要と言えます。
-
私達はiPS細胞由来血小板製剤の臨床応用を実現するために、血小板・巨核球培養効率を向上する戦略として「骨髄微小環境を応用する新しい培養システムの開発」を目指しています。
-
これまでの血小板・巨核球培養に関する基礎研究は、巨核球の分化成熟を制御する転写因子を対象にした細胞自律的なアプローチがメインでしたが、培養効率の改善は達成できていません。
-
つまり、血小板産生効率の改善を達成するためには巨核球の細胞自律的な増殖能力の向上だけでは限界があり、骨髄内の巨核球造血微小環境を模した、細胞間クロストークを念頭に置いた培養環境を整えることが重要だと考えています。
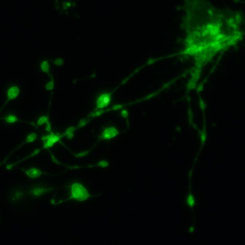
■ 骨髄オルガノイド作製への挑戦
- 「ミニ臓器」とも呼ばれるオルガノイドは、発生生物学、疾患病理学、細胞生物学、再生医療、薬物の毒性および有効性試験を含む幅広い分野の研究ツールとして期待されています。
- 骨髄オルガノイドも造血不全や造血器腫瘍の病態解明、さらにはそれら疾患への薬物評価モデルとして期待が寄せられています。しかし、多細胞・多因子で構成される骨髄環境は未解明な点が多く、その複雑な間質環境をin vitroで再現することが難しいため、オルガノイド作製は成功に至っていません。
- 私達は、PDPN陽性細網細胞が作り出す巨核球造血微小環境の研究で日々得られる知見を骨髄オルガノイド作製に応用し、再生医療やバイオマテリアル研究の発展に貢献することを目指します。
